Certains phénomènes biologiques nécessitent la présence d’enzymes.
L’organisme peut en fabriquer au fur et à mesure que le besoin se fait sentir. Ou il peut prévenir la demande par l’accumulation de réserves d’enzymes.
La première solution est lente et peut constituer un danger lorsque la situation exige une réponse immédiate.
Dans la coagulation, par exemple, la vitesse limitante est précisément la fabrication sur-le-champ d’un enzyme, la thromboplastine. Ce qui prend de quatre à cinq minutes.
Il suffirait qu’on ait à synthétiser tous les enzymes qui prennent part à la coagulation pour que le moindre traumatisme tissulaire entraine fatalement une hémorragie.
On choisit donc, presque toujours, l’accumulation de stocks d’enzymes.
Or ces derniers ont le défaut d’être des ‘pensionnaires grouillants’. Et du fait de leur grande réactivité — en moyenne, une molécule d’enzyme transforme mille molécules de substrat à la seconde — l’organisme préfère les emmagasiner sous forme inactive, quitte à les mobiliser et à les transformer rapidement en enzymes lorsque cela devient nécessaire.
Pour les mettre en réserve, l’organisme ne peut pas se permettre le luxe de les fabriquer pour ensuite les inactiver car une fois formés, les enzymes sont très souvent incontrôlables.
On préfère donc élaborer des précurseurs inoffensifs qu’on appelle zymogènes (ou proenzymes).
Dans la digestion, l’organisme sécrète des zymogènes dans la lumière du tube digestif où ils sont transformés en enzymes soit par d’autres enzymes qui y sont déjà, soit par hydrolyse spontanée en milieu acide.
Cela évite le danger que les cellules soient digérées par les enzymes qu’elles fabriquent.
Il existe de nombreux exemples de zymogènes. Citons le cas de prothrombine, transformée dans le sang en thrombine (active) sous l’action de la thromboplastine (dont nous avons parlé précédemment).
Ajoutons que la grande majorité des enzymes digestifs sont aussi sécrétés sous forme de zymogènes.
Pour illustrer le phénomène, imaginons un enzyme (E1) dont le rôle consiste à retirer une partie de la molécule de son substrat (S) :

Imaginons maintenant que le substrat soit le zymogène Z auquel un premier enzyme (appelé E1) doit retirer un verrou (ici triangulaire) qui l’empêche de fonctionner sous forme d’enzyme E2.

La transformation en enzyme se fait donc par catabolisme, plus précisément par dégradation d’un zymogène en métabolite actif.
Lorsque l’enzyme est capable de scinder des protéines, il arrive parfois qu’il puisse activer son propre zymogène :

On parlera alors d’autocatalyse.
Ce phénomène est caractérisé par le fait que la vitesse de formation de l’enzyme croit à mesure que l’enzyme active ses propres zymogènes (qui s’emploient aussitôt à faire pareil) pour atteindre un maximum, puis diminue à mesure que la quantité de zymogène restante se raréfie.
C’est ainsi que le pepsinogène est d’abord sécrété dans l’estomac où il est péniblement hydrolysé en pepsine par l’acidité de l’estomac. Mais aussitôt l’enzyme formé, la vitesse s’accélère car l’enzyme préside lui-même à la transformation de son précurseur.
En résumé, la transformation d’un zymogène en enzyme est une réaction irréversible qui ne peut être répétée avec la même facilité par une réaction chimique. Cette réaction implique le bris d’un lien peptidique et la libération d’un peptide.
De plus, l’autocatalyse est un phénomène qui se produit exclusivement chez les enzymes protéolytiques (qui ‘digèrent’ les protéines) et capables d’accepter leurs propres zymogènes comme substrats pour les transformer en enzymes.
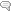
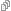

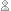 Écrit par Jean-Pierre Martel
Écrit par Jean-Pierre Martel